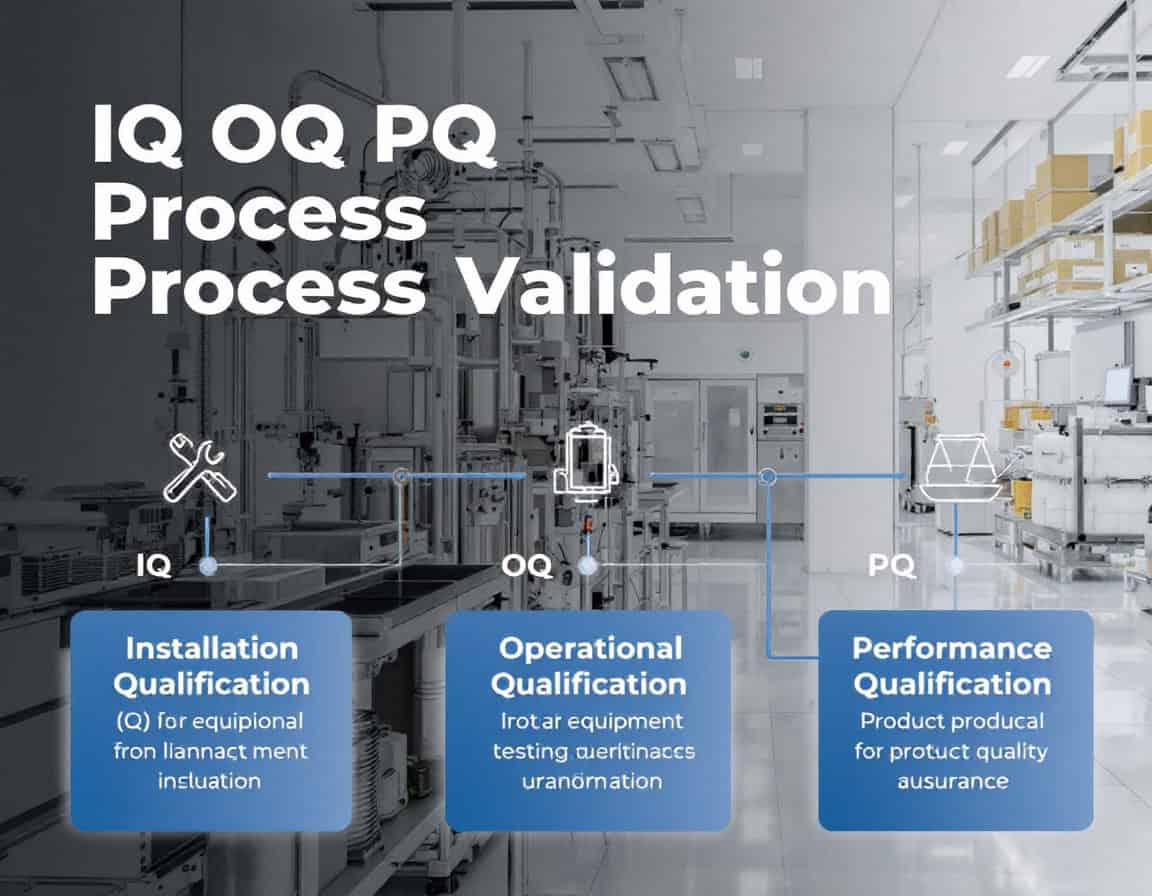
La méthodologie de validation du processus IQ OQ PQ, qui signifie Qualification d'installation (IQ), Qualification opérationnelle (OQ) et Qualification de performance (PQ), constitue la séquence établie. cadre Pour la validation des processus, elle sert à générer systématiquement des preuves documentées attestant qu'un processus de fabrication est sous contrôle. Cette méthodologie suit une progression délibérée et logique, commençant par la vérification statique et documentée de la bonne installation des équipements (QI), puis passant par la confirmation dynamique de leur fiabilité de fonctionnement dans les plages spécifiées (QO), et aboutissant à la démonstration que le processus intégré produit systématiquement des produits répondant à tous les critères de qualité (QP).
L’ensemble de la séquence est conçu pour fournir une preuve objective et traçable que le processus est robuste, reproductible et adapté à l’usage prévu avant toute utilisation commerciale.
Cette méthodologie est une condition réglementaire non négociable dans les industries régies par les BPF, telles que les produits pharmaceutiques, biologiques et dispositif médical La fabrication, où la cohérence des procédés est directement liée à la sécurité des patients, ne relève pas de la recherche initiale, mais de l'étape critique de validation, réalisée après la finalisation du développement du procédé et avant son approbation pour la production commerciale courante.
A Retenir

- Le résultat de la validation est une preuve, pas un produit.
- Les tests OQ « du pire des cas » impliquent des facteurs de stress combinés.
- PQ valide le processus intégré, pas seulement l’équipement.
- La règle des « trois lots » démontre la reproductibilité.
- Le succès du PQ est défini par la cohérence, et pas seulement par la réussite des spécifications.
- Le protocole est un contrat ; les écarts doivent être justifiés et bien documentés.
- Tirez parti de la documentation du fournisseur (FAT/SAT), mais ne remplacez pas votre propre OQ
- La validation définit le début du cycle de vie, et non la fin d’un projet.
- Tout changement « à l’identique » nécessite une justification.
- La formation du personnel est une condition préalable à la QO et à la QP
Qualification d'installation (QI)
La Qualification d'Installation (QI) est la phase initiale et fondamentale de la méthodologie de validation du processus QI/QO/QP. Il s'agit d'un processus formel et documenté qui vérifie et confirme que les équipements, systèmes et composants auxiliaires ont été livrés, installés et configurés conformément aux recommandations du fabricant et aux spécifications de conception de l'utilisateur.
Le principe fondamental d’IQ est de fournir des preuves documentées que l’installation est correcte et crée un environnement approprié et sûr pour les phases de qualification ultérieures.
Le but et l’importance du QI : L'objectif principal de la QI est d'établir une base de référence pour la validation de l'équipement. Avant tout essai opérationnel, il est crucial de s'assurer que l'équipement est physiquement présent, correctement assemblé et situé dans un environnement approprié. Cette phase permet d'atténuer les risques liés à une installation incorrecte, susceptible d'entraîner un dysfonctionnement de l'équipement, des problèmes de qualité du produit et des risques pour la sécurité.
Étapes et activités clés de la qualification d'installation
Le processus IQ est systématique et implique plusieurs étapes détaillées, généralement gérées par un protocole et une liste de contrôle pré-approuvés.
1. Pré-installation et planification
Avant même l'arrivée ou la commande de l'équipement, le processus de QI commence par une planification minutieuse. Cela comprend :
- Vérification de l'état de préparation du site : S'assurer que l'emplacement prévu est prêt à accueillir le nouvel équipement. Cela implique de vérifier l'espace au sol, le support structurel et la disponibilité des services publics nécessaires aux points de raccordement appropriés.
- Conditions environnementales : vérifier que l'environnement d'installation répond aux spécifications du fabricant en matière de température, d'humidité et de propreté.
- Rassembler la documentation : rassembler tous les documents essentiels, tels que le bon de commande, les manuels du fabricant, les spécifications de conception, les dessins techniques et les certificats d'étalonnage pour tous les instruments de mesure intégrés.
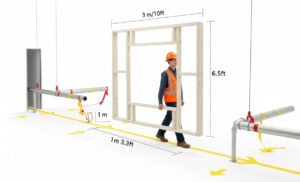
Conseil: Parcourez le parcours et modélisez le volume. Ne vous contentez pas de consulter un plan d'étage en 2D. C'est là que se produisent les pannes d'intelligence les plus courantes et les plus coûteuses. Parcourez le parcours prévu, du quai de chargement au point d'installation final, avec vos principaux intervenants (services techniques, ingénierie et chef de projet du fournisseur). Utilisez un simple cadre en bois ou en PVC, construit aux dimensions maximales de hauteur, de largeur et de longueur de la machine. Transportez physiquement ce cadre « fantôme » tout au long du parcours. Cela révélera les problèmes de dégagement liés aux portes, aux tuyaux bas, aux angles étroits et aux capacités des ascenseurs, souvent ignorés par les plans. Vérifiez également la capacité de charge du sol non seulement à l’emplacement final, mais tout au long du trajet de transit.

2. Réception et vérification de l'équipement
Une fois le matériel livré, une inspection approfondie est effectuée :
- Vérification des composants : les articles livrés sont méticuleusement vérifiés par rapport à la liste de colisage et au bon de commande pour confirmer que tous les composants, y compris les logiciels, ont été reçus et correspondent au modèle et à la version commandés.
- Inspection des dommages : une inspection visuelle est effectuée pour s'assurer qu'aucun dommage n'est survenu pendant l'expédition et la manutention.
Note: Dans la plupart des industries appliquant la méthodologie QI/QO/QP, l'équipement doit être accompagné de ses certificats de conformité (marquages CE/FDA…), éventuellement d'autres certificats et, éventuellement, de résultats de tests internes au fabricant. Ces documents doivent être considérés au même titre que les biens eux-mêmes. En effet, une livraison doit être refusée si ces documents ne sont pas inclus ou reçus à l'avance (au moins en zone de quarantaine).
Conseil connexe : Faites confiance, mais vérifiez le micrologiciel. La liste de colisage est le strict minimum. Concentrez-vous sur les composants critiques et, surtout, sur les versions logicielles et micrologicielles. Un fournisseur pourrait vous livrer une version plus récente et « améliorée », mais non validée pour votre processus. Avant le départ du livreur et avant de signer les documents d'expédition, prenez des photos haute résolution des plaques signalétiques de tous les composants critiques (moteurs, pompes, contrôleurs) et de la plaque signalétique principale. Si possible, allumez le contrôleur uniquement pour vérifier la version du micrologiciel/logiciel sur l'écran de démarrage. Comparez-la à la version spécifiée dans votre cahier des charges utilisateur (URS) ou votre bon de commande. Il est bien plus facile de refuser la livraison à la porte que de gérer l'écart ultérieurement.
3. Vérification de l'installation et de la connexion
C'est le cœur du processus IQ, où l'installation physique est examinée :

- Montage et placement corrects : vérifier que l'équipement est assemblé et positionné conformément aux instructions du fabricant et aux dessins techniques.
- Raccordements aux services publics : Il s'agit d'une étape cruciale qui implique de confirmer toutes les connexions aux services essentiels. Cela comprend la vérification des points suivants :
- Électrique: l'alimentation électrique correspond à la tension et à la phase requises, et que des circuits de mise à la terre et de sécurité appropriés sont en place.
- Plomberie: les raccordements pour l'eau, la vapeur ou le drainage sont correctement installés, sans fuite et fabriqués avec les matériaux appropriés.
- Gaz et air comprimé : toutes les conduites pneumatiques et de gaz sont correctement connectées et la pression et la qualité répondent aux spécifications.
- Équipements auxiliaires : s'assurer que tout équipement de support ou périphérique est également correctement installé et connecté.
- Installation du logiciel :pour les systèmes contrôlés par ordinateur, il s'agit de vérifier que le logiciel est correctement installé, la communication avec le...
You have read 14% of the article. The rest is for our community. Already a member? Se connecter
(et aussi pour protéger notre contenu original contre les robots d'indexation)
Communauté mondiale de l'innovation
Se connecter ou s'inscrire (100% gratuit)
Voir la suite de cet article et tous les contenus et outils réservés aux membres.
Uniquement de vrais ingénieurs, fabricants, concepteurs et professionnels du marketing.
Pas de bot, pas de hater, pas de spammer.
Lectures connexes
- Plan directeur de validation (PDV) : le document stratégique de haut niveau qui définit la philosophie globale de validation de l'entreprise, la portée, les responsabilités et les systèmes et processus spécifiques à valider.
- Spécification des exigences de l'utilisateur (URS) : le document fondamental qui détaille ce que l'équipement ou le processus est censé faire du point de vue de l'utilisateur final et de la qualité, constituant la base de tous les tests ultérieurs.
- Tests d'acceptation en usine (FAT) et tests d'acceptation sur site (SAT) : tests précurseurs dirigés par l'ingénierie, souvent effectués avec le fournisseur, pour vérifier la fonctionnalité de l'équipement avant l'expédition (FAT) et après l'installation (SAT), qui peuvent être exploités pour rationaliser IQ/OQ.
- Validation du système informatique (CSV) : une discipline de validation spécialisée qui fonctionne en parallèle avec IQ OQ PQ, en se concentrant sur l'intégrité, la sécurité et la fiabilité des logiciels et des systèmes informatisés contrôlant l'équipement.
- Conformité à la partie 11 du CFR 21 : l'ensemble spécifique de réglementations de la FDA régissant les enregistrements électroniques et les signatures électroniques, un élément essentiel du CSV pour garantir l'intégrité des données, les pistes d'audit et le contrôle d'accès.
- Validation du nettoyage : un processus de validation parfois séparé mais lié, effectué sur le même équipement pour prouver qu'une procédure de nettoyage peut éliminer efficacement et systématiquement les résidus de produits, les agents de nettoyage et la contamination microbienne (nous recommandons fortement de l'inclure dans le protocole IQ OQ PQ, car l'état de nettoyage fait partie intégrante des performances du produit et du processus).
- Analyse du système de mesure (MSA) / Gage R&R : la méthodologie statistique utilisée pour valider les *méthodes de test* elles-mêmes, garantissant que le système de mesure utilisé pour juger de la qualité du produit est précis, exact, répétable et reproductible.
- Validation basée sur les risques (utilisant AMDEC/HACCP) : la méthodologie d'identification des modes de défaillance potentiels et des risques pour la qualité du produit, permettant de concentrer les efforts de validation sur les paramètres de processus les plus critiques (CPP).
- Attributs de qualité critiques (CQA) et paramètres de processus critiques (CPP) : les caractéristiques spécifiques et définies du produit (CQA) et les variables de processus (CPP) qui doivent être contrôlées pour garantir la qualité de produit souhaitée, qui constituent les critères d'acceptation du PQ.
- Capacité de traitement Analyse (Cpk/Ppk) : l'analyse statistique effectuée sur les données PQ pour quantifier dans quelle mesure un processus est centré dans ses limites de spécification et dans quelle mesure il présente une variabilité, fournissant un score numérique de sa « capacité ».
- Vérification continue des processus (CPV) : l'« étape 3 » moderne de la validation du processus, qui implique la surveillance continue des paramètres du processus et des attributs de qualité pendant la production de routine pour garantir que le processus reste dans un état de contrôle constant.
- Gestion du contrôle des changements : la procédure formelle du système qualité permettant d'évaluer, de documenter et d'approuver toute modification proposée à un système ou à un processus validé afin de garantir qu'il ne quitte pas involontairement son état validé.
- Gestion des écarts et des CAPA : le système permettant d'enquêter, de déterminer la cause profonde et de mettre en œuvre des mesures correctives et préventives pour tout événement imprévu événements ou des échecs survenant pendant ou après la validation.
- Validation rétrospective : une approche de validation obsolète, désormais rarement acceptable, basée sur l'analyse des données de production historiques d'un processus existant et non validé pour tenter de prouver qu'il a fonctionné dans un état de contrôle.
- Rapport de synthèse de validation (VSR) : le document final et concluant qui résume l'ensemble de l'effort de validation (IQ OQ PQ), présente les résultats clés, aborde les écarts éventuels et déclare formellement le système ou le processus comme validé et apte à une utilisation commerciale.
Liens externes sur la validation des processus IQ OQ PQ
Normes internationales
(survolez le lien pour voir notre description du contenu)
Glossaire des termes utilisés
American Society for Testing and Materials (ASTM): une organisation internationale de normalisation qui élabore et publie des normes techniques consensuelles volontaires pour les matériaux, les produits, les systèmes et les services, visant à améliorer la qualité et la sécurité dans divers secteurs.
Calculation of Process Capability (Cpk): une mesure statistique qui évalue la capacité d'un processus à produire des résultats dans des limites spécifiées, calculée en évaluant la distance entre la moyenne du processus et la limite de spécification la plus proche, normalisée par l'écart type du processus.
Computer Numerically Controlled (CNC): un processus de fabrication qui utilise un logiciel informatique programmé pour contrôler les machines-outils, permettant un fonctionnement précis et automatisé pour des tâches telles que la découpe, le fraisage, le perçage et la gravure de matériaux.
Continuous Integration/Continuous Deployment (CI/CD): une pratique de développement logiciel qui automatise l'intégration des modifications de code et le déploiement dans les environnements de production, permettant des mises à jour fréquentes, une livraison plus rapide et une meilleure collaboration entre les équipes de développement et d'exploitation grâce à des tests et une surveillance automatisés.
Corrective Action and Preventative Action (CAPA): une approche systématique visant à identifier, enquêter et traiter les non-conformités et les problèmes potentiels afin de prévenir les récidives et de garantir la conformité aux normes réglementaires dans les systèmes de gestion de la qualité.
Critical Control Points (CCP): Étapes spécifiques d'un processus où des mesures de contrôle peuvent être appliquées pour prévenir, éliminer ou réduire les risques liés à la sécurité alimentaire à des niveaux acceptables. L'identification de ces points est essentielle pour une analyse efficace des risques et une gestion des contrôles critiques dans les systèmes de production alimentaire.
current Good Manufacturing Practice (cGMP): un système garantissant que les produits sont fabriqués et contrôlés de manière cohérente conformément aux normes de qualité, englobant les réglementations et les lignes directrices relatives aux processus de fabrication, aux installations, à l'équipement et au personnel afin de garantir la sécurité, la qualité et l'efficacité dans les industries pharmaceutiques, alimentaires et autres industries réglementées.
Defects Per Million Opportunities (DPMO): une mesure utilisée dans le contrôle qualité qui quantifie le nombre de défauts dans un processus par million d'opportunités d'erreur, calculée en divisant le nombre de défauts par le nombre total d'opportunités et en multipliant par un million.
Define Measure Analyze Improve Control (DMAIC): une stratégie de qualité axée sur les données utilisée dans Six Sigma pour l'amélioration des processus, composée de cinq phases : identifier le problème, mesurer les performances actuelles, analyser les données pour identifier les causes, améliorer les processus en fonction des résultats et contrôler les performances futures pour maintenir les améliorations.
Design Validation (DV): un processus visant à garantir qu'un produit répond aux exigences spécifiées et à l'utilisation prévue par le biais de tests et d'évaluations, confirmant que la conception remplit son objectif et fonctionne correctement dans des conditions réelles.
Failure Mode and Effects Analysis (FMEA): une méthode systématique permettant d'évaluer les modes de défaillance potentiels au sein d'un système, d'un processus ou d'un produit, d'évaluer leurs effets sur les performances et de hiérarchiser les risques afin d'améliorer la fiabilité et la sécurité grâce à des actions correctives.
Food and Drug Administration (FDA): une agence fédérale du ministère de la Santé et des Services sociaux des États-Unis chargée de réglementer la sécurité alimentaire, les produits pharmaceutiques, les dispositifs médicaux, les cosmétiques et les produits du tabac afin de garantir la santé et la sécurité publiques grâce à une évaluation scientifique et à l'application des normes de conformité.
Good Manufacturing Practice (GMP): Un système garantissant que les produits sont fabriqués et contrôlés de manière cohérente, conformément aux normes de qualité, minimisant ainsi les risques liés à la production pharmaceutique et aux industries connexes. Il comprend des directives relatives aux procédés de fabrication, aux conditions des installations, aux qualifications du personnel et aux pratiques de documentation afin de garantir la sécurité et l'efficacité des produits.
Hazard Analysis and Critical Control Points (HACCP): une approche systématique de la sécurité alimentaire qui identifie, évalue et contrôle les dangers aux points critiques du processus de production afin de prévenir les maladies d’origine alimentaire et de garantir la sécurité des produits.
Installation Qualification (IQ): un processus documenté pour vérifier que l'équipement ou les systèmes sont installés conformément aux spécifications, y compris l'évaluation des services publics, des conditions environnementales et la conformité aux exigences de conception, garantissant ainsi la préparation à la qualification opérationnelle.
Measurement System Analysis (MSA): une méthode statistique utilisée pour évaluer l'exactitude, la précision et la fiabilité des processus et instruments de mesure, garantissant que les données collectées sont valides et cohérentes pour la prise de décision en matière de contrôle qualité et d'amélioration des processus.
Operational Qualification (OQ): un processus de validation qui garantit que les équipements ou les systèmes fonctionnent conformément aux exigences spécifiées dans des limites définies, confirmant qu'ils fonctionnent comme prévu dans leur environnement opérationnel.
Performance Qualification (PQ): un processus qui vérifie qu'un système ou un équipement fonctionne conformément aux exigences spécifiées dans des conditions réelles, garantissant qu'il remplit systématiquement sa fonction prévue dans des limites prédéterminées.
Process Capability Index (Cpk): une mesure statistique qui quantifie dans quelle mesure un processus peut produire des résultats dans des limites spécifiées, indiquant la relation entre la moyenne du processus et la limite de spécification la plus proche, ajustée en fonction de la variabilité du processus.
Process Performance Index (Ppk): Mesure statistique quantifiant le degré de conformité d'un processus aux spécifications, calculée à partir de la moyenne et de l'écart type du processus. Elle indique la capacité d'un processus à produire des résultats dans des limites définies, en tenant compte à la fois de la variabilité et du centrage.
Product Lifecycle Management (PLM): une approche systématique de la gestion du cycle de vie d'un produit depuis sa création, en passant par la conception technique et la fabrication, jusqu'au service et à l'élimination, en intégrant les personnes, les processus, les données et la technologie pour améliorer la qualité du produit, réduire les délais de mise sur le marché et améliorer la collaboration entre les parties prenantes.
Production Part Approval Process (PPAP): une procédure normalisée utilisée dans la fabrication pour garantir que les fournisseurs répondent aux exigences de qualité avant la production en série, impliquant la documentation et la validation des spécifications de conception, des capacités de processus et des échantillons de production pour confirmer la conformité aux attentes des clients.
Quality Management System (QMS): un système structuré de processus, de procédures et de responsabilités visant à garantir une qualité constante des produits et des services, à faciliter l’amélioration continue et à répondre aux exigences des clients et des réglementations.
Standard Operating Procedure (SOP): un ensemble d'instructions étape par étape créées pour aider les travailleurs à effectuer des opérations de routine de manière cohérente et efficace, garantissant le respect des réglementations et des normes de qualité.
Statistical Process Control (SPC): une méthode de contrôle de la qualité qui utilise des techniques statistiques pour surveiller et contrôler un processus, garantissant qu'il fonctionne à son plein potentiel en identifiant les variations et en maintenant une production cohérente dans des limites spécifiées.
User Requirement Specification (URS): un document détaillant les besoins et les attentes des utilisateurs pour un système ou un produit, décrivant les exigences fonctionnelles et non fonctionnelles pour guider le développement et assurer l'alignement avec les objectifs des utilisateurs.























Articles Similaires
Plan de Contrôle de la Contamination et 26 Meilleures Pratiques de Salle Blanche
Du GMP au cGMP : le guide Complet pour Maîtriser
Les stratégies du « Fou Solitaire », du « First Follower » et du « Fast Follower »
Les 20 Meilleures Utilisations de Proxies pour l'Ingénierie
Comment Vendre de la Glace aux Esquimaux (ou Manigances Marketing)
Greenwashing : les 15 meilleurs conseils d'un gentleman pour une tromperie exquise