IQ OQ PQ 过程验证方法,代表安装确认 (IQ)、操作确认 (OQ) 和性能确认 (PQ) 序列,构成了既定的 框架 用于工艺验证,系统地生成文件化证据,证明生产工艺处于受控状态。该方法遵循严谨的逻辑流程,首先进行静态文件化验证,确认设备安装正确 (IQ),然后进行动态确认,确认设备在规定范围内可靠运行 (OQ),最后证明集成工艺能够持续生产出符合所有质量属性的产品 (PQ)。
整个序列旨在提供客观、可追溯的证据,证明该过程在商业使用之前是稳健的、可重复的并且适合其预期用途。
这种方法是 cGMP 管理的行业(如制药、生物制剂和 医疗器械 制造工艺的一致性与患者安全直接相关。其应用并非用于初步研究,而是在工艺开发完成后、获准进行常规商业化生产之前进行的关键验证阶段。
关键要点

- 验证的输出是证据,而不是产品。
- “最坏情况” OQ 测试涉及组合压力源。
- PQ 验证的是集成过程,而不仅仅是设备。
- “三批”规则体现了可重复性。
- PQ 的成功取决于一致性,而不仅仅是通过规范。
- 该协议是一种合同;偏差必须有合理的依据并有充分的记录。
- 利用供应商文档(FAT/SAT),但不要取代您自己的 OQ
- 验证定义了生命周期的开始,而不是项目的结束。
- 任何“同类”的改变都需要理由。
- 人员培训是OQ和PQ的先决条件
安装确认(IQ)
安装确认 (IQ) 是 IQ OQ PQ 流程验证方法的初始和基础阶段。它是一个正式的、记录在案的流程,用于验证并确认设备、系统和辅助组件已完全按照制造商的建议和用户的设计规范进行交付、安装和配置。
IQ 的核心原则是提供文件证据证明安装正确,并为后续的鉴定阶段创造合适、安全的环境。
IQ 的目的和重要性: 设备质量验证 (IQ) 的主要目标是建立设备验证的基准。在开始任何操作测试之前,至关重要的是确保设备实际存在、正确组装并放置在合适的环境中。此阶段可以降低与不当安装相关的风险,否则可能导致设备故障、产品质量问题和安全隐患。
安装确认的关键阶段和活动
IQ 流程是系统的,涉及几个详细的阶段,通常通过预先批准的协议和清单进行管理。
1. 安装前和规划
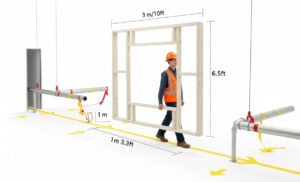
在设备到达或订购之前,质量评估流程就已从周密的规划开始。这包括:
- 场地准备情况验证: 确保指定位置已为新设备做好准备。这包括检查是否有足够的占地面积、结构支撑,以及在正确的连接点是否配备必要的公用设施。
- 环境条件: 验证安装环境是否符合制造商对温度、湿度和清洁度的规范。
- 收集文件: 收集所有必要的文件,例如采购订单、制造商手册、设计规范、工程图和任何综合测量仪器的校准证书。
提示: 走一遍路线,并建模体积。不要只看二维平面图。最常见且代价高昂的IQ失败往往发生在这里。与关键利益相关者(设施部门、工程部门和供应商的项目经理)一起,沿着从装卸码头到最终安装点的规划路线走一遍。使用一个简单的木制或PVC框架,根据机器的最大高度、宽度和长度尺寸建造。沿着整个路径实际搬运这个“幽灵”框架。这将揭示图纸经常遗漏的诸如门道、低垂管道、狭窄拐角和电梯容量等净空问题。 此外,不仅要验证最终位置的地板承载能力,还要验证整个运输路径的地板承载能力。

2. 设备接收与验证
设备交付后,将进行彻底检查:
- 组件验证: 所交付的物品将根据装箱单和采购订单进行仔细检查,以确认已收到包括软件在内的所有组件,并且是订购的正确型号和版本。
- 损坏检查: 进行目视检查以确保在运输和搬运过程中没有发生损坏。
笔记: 在大多数采用IQ OQ PQ方法的行业中,设备应附带符合性证书(例如CE、FDA标志等),以及其他证书,以及一些制造商自己的测试结果。这些文件应与实物本身同等重要。事实上,如果未包含这些文件或未提前收到(至少在隔离区),则应拒绝收货。
相关提示: 信任,但要验证固件。装箱单只是最低限度的清单。您真正应该关注的是关键组件,以及最重要的软件和固件版本。供应商可能会发送一个更新、“更好”的版本,而该版本尚未经过您的流程验证。在送货司机离开之前以及在您签署任何装运单据之前,请拍摄所有关键组件(电机、泵、控制器)铭牌和主设备铭牌的高分辨率照片。如果可能,仅在启动屏幕上验证固件/软件版本时才打开控制器单元。将此版本与您的用户需求规范 (URS) 或采购订单中指定的版本进行交叉比对。当场拒收货物远比事后处理差异容易得多。
3. 安装和连接验证
这是 IQ 流程的核心,其中对物理安装进行了仔细检查:

- 正确的组装和放置: 验证设备是否按照制造商的说明和工程图进行组装和定位。
- 公用设施连接: 这是至关重要的一步,涉及确认所有基本服务的连接。这包括检查:
- 电气: 电源是否与所需电压和相位相匹配,并且接地和安全电路是否正确到位。
- 管道: 水、蒸汽或排水连接件安装正确、无泄漏且采用合适的材料制成。
- 气体和压缩空气: 所有气动和气体管路均正确连接,压力和质量符合规格。
- 辅助设备: 确保任何支持或外围设备也正确安装和连接。
- 软件安装:对于计算机控制系统来说,这包括验证软件安装是否正确、与系统的通信是否正常、是否存在故障。
您已阅读了文章的 14%。其余部分为社区内容。已经是会员? 登录
(同时也是为了保护我们的原创内容不被机器人搜刮)。
创新世界社区
登录或注册(100% 免费)
查看本文其余部分以及所有会员专享内容和工具。
只有真正的工程师、制造商、设计师和营销人员才是专业人士。
没有机器人,没有仇恨者,没有垃圾邮件发送者。
相关阅读
- 验证总体规划(VMP): 定义公司整体验证理念、范围、职责以及需要验证的具体系统和流程的高级战略文件。
- 用户需求规范 (URS): 基础文件详细说明了从最终用户和质量角度来看设备或流程的预期功能,为所有后续测试奠定了基础。
- 工厂验收测试(FAT)和现场验收测试(SAT): 工程主导的前体测试,通常与供应商一起执行,以验证设备在装运前(FAT)和安装后(SAT)的功能,这可以用来简化 IQ/OQ。
- 计算机系统验证(CSV): 与 IQ OQ PQ 并行运行的专门验证学科,重点关注控制设备的软件和计算机系统的完整性、安全性和可靠性。
- 21 CFR 第 11 部分合规性: FDA 制定的有关管理电子记录和电子签名的特定法规,是 CSV 的重要组成部分,用于确保数据完整性、审计跟踪和访问控制。
- 清洁验证: 有时在同一设备上执行分离但相关的验证过程,以证明清洁程序可以有效且持续地去除产品残留物、清洁剂和微生物污染(我们强烈建议将其纳入 IQ OQ PQ 协议中,因为清洁状态是产品和工艺性能不可或缺的一部分)。
- 测量系统分析 (MSA)/量具 R&R: 用于验证*测试方法*本身的统计方法,确保用于判断产品质量的测量系统准确、精确、可重复和可再现。
- 基于风险的验证(使用 FMEA/HACCP): 识别潜在故障模式和产品质量风险的方法,使验证工作能够集中在最关键的过程参数(CPP)上。
- 关键质量属性 (CQA) 和关键工艺参数 (CPP): 必须控制特定的、定义的产品特性 (CQA) 和过程变量 (CPP),以确保所需的产品质量,这些构成了 PQ 的验收标准。
- 加工能力 分析 (Cpk/Ppk): 对 PQ 数据进行的统计分析,以量化流程在其规格限度内的集中程度以及其可变性,从而提供其“能力”的数值分数。
- 持续过程验证(CPV): 现代工艺验证的“第三阶段”,涉及在常规生产过程中持续监控工艺参数和质量属性,以确保工艺保持持续的控制状态。
- 变更控制管理: 正式的质量体系程序,用于评估、记录和批准对已验证系统或流程的任何拟议变更,以确保其不会无意中退出已验证状态。
- 偏差和 CAPA 管理: 针对任何意外情况进行调查、确定根本原因并实施纠正和预防措施的系统 事件 或在验证期间或验证之后发生的失败。
- 回顾性验证: 一种过时的验证方法,现在很少被接受,该方法基于分析现有未经验证的流程的历史生产数据,试图证明其一直处于受控状态。
- 验证摘要报告(VSR): 最终的、结论性的文件,总结了整个验证工作(IQ OQ PQ),展示了关键结果,解决了任何偏差,并正式宣布系统或流程已经验证并适合商业使用。
IQ OQ PQ 工艺验证的外部链接
(将鼠标悬停在链接上即可查看内容描述)
术语表
American Society for Testing and Materials (ASTM): 一个国际标准组织,负责制定和发布材料、产品、系统和服务的自愿共识技术标准,旨在提高各个行业的质量和安全。
Calculation of Process Capability (Cpk): 一种统计测量,用于评估过程在指定限制内产生输出的能力,通过评估过程平均值和最近的规格限制之间的距离来计算,并通过过程标准偏差进行标准化。
Computer Numerically Controlled (CNC): 一种使用编程计算机软件控制机床的制造过程,可实现切割、铣削、钻孔和雕刻材料等任务的精确和自动化操作。
Continuous Integration/Continuous Deployment (CI/CD): 一种软件开发实践,可自动将代码更改集成并部署到生产环境,通过自动化测试和监控实现频繁更新、更快交付以及改善开发和运营团队之间的协作。
Corrective Action and Preventative Action (CAPA): 一种系统的方法来识别、调查和解决不符合项和潜在问题,以防止再次发生并确保遵守质量管理体系的监管标准。
Critical Control Points (CCP): 生产过程中可实施控制措施以预防、消除或将食品安全危害降低至可接受水平的特定阶段。识别这些环节对于食品生产系统中有效的危害分析和关键控制管理至关重要。
current Good Manufacturing Practice (cGMP): 确保产品始终按照质量标准进行生产和控制的系统,涵盖制造流程、设施、设备和人员的规定和指南,以确保制药、食品和其他受监管行业的安全、质量和功效。
Defects Per Million Opportunities (DPMO): 质量控制中使用的一种测量方法,用于量化每百万次错误机会中流程的缺陷数,计算方法是将缺陷数除以总机会数,然后乘以一百万。
Define Measure Analyze Improve Control (DMAIC): 六西格玛用于流程改进的数据驱动质量策略,包括五个阶段:识别问题、衡量当前绩效、分析数据以识别原因、根据调查结果改进流程以及控制未来绩效以维持改进。
Design Validation (DV): 通过测试和评估来确保产品满足指定要求和预期用途的过程,确认设计满足其目的并在实际条件下正确运行。
Failure Mode and Effects Analysis (FMEA): 一种系统方法,用于评估系统、流程或产品中的潜在故障模式,评估其对性能的影响,并确定风险的优先顺序,以通过纠正措施提高可靠性和安全性。
Food and Drug Administration (FDA): 美国卫生与公众服务部的一个联邦机构,负责监管食品安全、药品、医疗器械、化妆品和烟草产品,通过科学评估和执行合规标准来确保公众健康和安全。
Good Manufacturing Practice (GMP): 确保产品始终按照质量标准进行生产和控制的体系,最大限度地降低药品生产及相关行业的风险。该体系涵盖生产流程、设施条件、人员资质和文件规范的指南,以确保产品的安全性和有效性。
Hazard Analysis and Critical Control Points (HACCP): 一种系统的食品安全方法,识别、评估和控制生产过程中关键点的危害,以防止食源性疾病并确保产品安全。
Installation Qualification (IQ): 一个记录的过程,用于验证设备或系统是否按照规范安装,包括对公用设施、环境条件和符合设计要求的评估,确保准备好进行操作鉴定。
Measurement System Analysis (MSA): 一种统计方法,用于评估测量过程和仪器的准确性、精确度和可靠性,确保收集的数据有效且一致,以便进行质量控制和过程改进的决策。
Operational Qualification (OQ): 验证过程确保设备或系统在规定的限制内按照指定的要求运行,确认它们在其运行环境中按预期运行。
Performance Qualification (PQ): 验证系统或设备在实际条件下按照指定要求运行的过程,确保其在预定限制内始终执行其预期功能。
Process Capability Index (Cpk): 一种统计测量方法,用于量化过程在指定限制内产生输出的能力,指示过程平均值与最接近的规格限制之间的关系,并根据过程变化进行调整。
Process Performance Index (Ppk): 一种统计指标,用于量化过程符合规格限值的程度,使用过程平均值和标准差计算得出。它表示过程在规定限值范围内产生输出的能力,同时考虑了变异性和中心性。
Product Lifecycle Management (PLM): 一种系统的方法,用于管理产品从开始到工程设计和制造、再到服务和处置的生命周期,整合人员、流程、数据和技术,以提高产品质量、缩短上市时间并加强利益相关者之间的协作。
Production Part Approval Process (PPAP): 制造业中使用的标准化程序,以确保供应商在批量生产之前满足质量要求,包括设计规范、工艺能力和生产样品的记录和验证,以确认符合客户的期望。
Quality Management System (QMS): 一套结构化的流程、程序和责任体系,旨在确保产品和服务的质量始终如一、促进持续改进并满足客户和监管要求。
Standard Operating Procedure (SOP): 一套分步说明,旨在帮助工人持续高效地执行日常操作,确保遵守法规和质量标准。
Statistical Process Control (SPC): 一种质量控制方法,采用统计技术来监视和控制过程,通过识别变化并在指定的限制内保持一致的输出来确保其充分发挥其潜力。
User Requirement Specification (URS): 一份详细说明用户对系统或产品的需求和期望的文档,概述了功能性和非功能性需求,以指导开发并确保与用户目标保持一致。























相关文章
污染控制策略和洁净室26个最佳实践
从 GMP 到 cGMP:完整的母带制作指南
“孤独的坚果”、“第一个追随者”和“快速追随者”策略
工程领域代理的 20 个最佳用途
如何向爱斯基摩人销售冰块(又称营销诡计)
漂绿:绅士的15个绝妙欺骗技巧