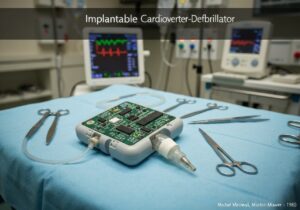
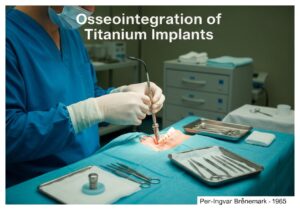
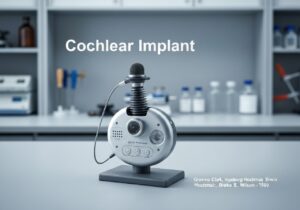
Les dispositifs médicaux sont classés en classes selon le risque qu'ils présentent pour les patients et les utilisateurs. Cette approche basée sur le risque, utilisée par les organismes de réglementation comme la FDA américaine et l'UE, comporte généralement trois ou quatre niveaux (par exemple, classes I, IIa, IIb, III). Les dispositifs à faible risque, comme les abaisse-langues, sont de classe I, tandis que les dispositifs à haut risque et essentiels au maintien de la vie, comme les stimulateurs cardiaques, sont de classe III.