Le Buone Pratiche di Fabbricazione, o GMP, sono lo standard universale per la produzione di qualità. Si tratta di un insieme di regole volte a garantire che prodotti come medicinali, alimenti e dispositivi medici siano realizzati in modo coerente e sicuro, lotto dopo lotto. L'idea centrale è semplice: la qualità non può essere ispezionata in un prodotto a fine linea. Deve invece essere integrata in ogni fase del processo produttivo, dalle materie prime che arrivano alla banchina di carico fino alla confezione finale che ne esce.
La "c" di cGMP sta per "Attuale". Questa singola lettera introduce un requisito critico e dinamico. Mentre le GMP forniscono il regolamento fondamentale, le cGMP obbligano legalmente i produttori a utilizzare le tecnologie, i sistemi e le conoscenze scientifiche più aggiornate oggi disponibili. Un processo che era perfettamente accettabile secondo gli standard GMP un decennio fa potrebbe non superare un'ispezione cGMP oggi, se nel frattempo sono emersi metodi migliori e più affidabili. Ciò obbliga le aziende a migliorare costantemente.
Punti Chiave

- La distinzione tra GMP e cGMP è ormai un fatto accademico; l'aspettativa è universale.
- Il motore è la gestione del rischio di qualità (QRM), non la burocrazia né il PLM.
- L'integrità dei dati è un obiettivo primario dell'audit.
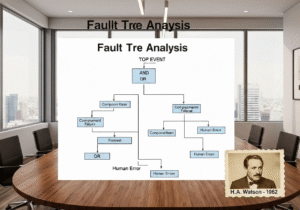
- L'"errore umano" è un sintomo, non una causa principale. Attribuire una deviazione a un "errore umano" è un segnale d'allarme per un sistema di qualità debole.
- La tecnologia analitica di processo (PAT) incarna il passaggio dal testing alla garanzia in tempo reale. La "c" di cGMP è esemplificata dalla PAT.
- La supervisione dei fornitori è basata sui dati, non solo sugli audit.
- La Persona Qualificata (QP) rappresenta una responsabilità critica specifica dell'UE.
- IL Strategia di controllo della contaminazione (CCS) è la nuova pietra miliare della produzione sterile.
I 10 principi fondamentali delle buone pratiche di fabbricazione (GMP)
Le GMP non sono solo un insieme di regole, ma una mentalità di qualità basata su dieci principi fondamentali. Questi principi lavorano insieme per creare un sistema solido che garantisce che la qualità sia integrata in un prodotto in ogni fase, anziché essere semplicemente testata alla fine.

1. Scrivere procedure passo passo e istruzioni di lavoro
Il fondamento delle GMP è garantire che tutti i processi siano chiaramente definiti e documentati. Questo principio richiede la creazione di Procedure Operative Standard (SOP) dettagliate e inequivocabili per ogni attività critica. L'obiettivo è garantire che le operazioni vengano eseguite in modo coerente e corretto ogni volta, indipendentemente da chi le esegue. Ciò elimina le ambiguità e fornisce un riferimento chiaro per la formazione e l'esecuzione.
Esempio di applicazione: Un'azienda, "PharmaBlend Inc.", produce un farmaco liquido termosensibile. La loro SOP per il "Compounding Tank Temperature Control" (SOP-MFG-101) specifica non solo la temperatura target (40 °C ± 2 °C), ma anche la sequenza esatta per l'avvio della camicia di riscaldamento, la velocità di aumento della temperatura (non superiore a 5 °C al minuto), la sonda calibrata specifica da utilizzare per il monitoraggio e le azioni da intraprendere in caso di superamento della temperatura.
Mancia: Invece di scrivere SOP monolitiche, utilizzate un approccio modulare. Create SOP "master" per processi complessi che facciano riferimento a documenti di "istruzioni di lavoro" più piccoli e specifici per le singole fasi (ad esempio, la calibrazione di un sensore specifico, l'azionamento di una singola valvola). Questo semplifica gli aggiornamenti: se si sostituisce un singolo componente dell'apparecchiatura, è sufficiente rivedere una sola piccola istruzione di lavoro anziché l'intera SOP di processo, riducendo significativamente i tempi di revisione e approvazione e minimizzando il rischio di introdurre errori in sezioni non correlate.
2. Seguire meticolosamente le procedure e le istruzioni

Avere procedure documentate è inutile se non vengono seguite. Questo principio richiede la rigorosa aderenza alle SOP scritte, senza alcuna deviazione. Se una deviazione è necessaria, deve essere formalmente documentata, giustificata e approvata attraverso un processo di controllo delle modifiche definito. Ciò garantisce che qualsiasi deviazione dallo standard sia controllata, valutata in termini di rischio e registrata per la tracciabilità.
Mancia: Implementare una metrica "Right-First-Time" (RFT) per l'esecuzione delle procedure, monitorata durante la revisione dei batch record. Quando si verificano deviazioni dovute alla non aderenza, non limitarsi a riqualificare l'operatore. Eseguire un'analisi delle cause profonde incentrata sull'usabilità della procedura (approccio basato sui fattori umani). Le istruzioni erano ambigue? La sequenza era illogica? Lo strumento richiesto è di difficile accesso? Migliorare la procedura stessa è un'azione correttiva e preventiva (CAPA) più efficace a lungo termine rispetto al semplice attribuire la colpa all'errore umano.
3. Documentare il lavoro in modo tempestivo e accurato

Questo è il principio del "se non è stato scritto, non è successo". Tutte le attività, dal ricevimento delle materie prime alla spedizione del prodotto finale, devono essere documentate in tempo reale. Ciò include la registrazione di dati, firme, date ed eventuali osservazioni. Una documentazione accurata e aggiornata fornisce una cronologia completa e tracciabile di un lotto (nota come Batch Record o Device History Record), essenziale per indagare sulle deviazioni, risolvere i problemi e dimostrare la conformità durante un audit.
Mancia: Quando si progettano record batch (cartacei o elettronici), è opportuno integrare i "controlli di integrità dei dati" direttamente nei campi. Ad esempio, invece di un semplice spazio vuoto per "Ora di fine", strutturarlo in modo da richiedere un'ora di inizio e un'ora di fine, con un controllo automatico o manuale per garantire che la durata sia logica per la fase del processo. Per le voci critiche, utilizzare firme di "verifica da parte di una seconda persona", ma assicurarsi che il verificatore sia addestrato a ripetere il calcolo critico o controlla l'impostazione, non semplicemente "seleziona la casella".
Differenza tra DMR e DHR:
- Il Device Master Record, o DMR, è la ricetta principale per un dispositivo medicoSi tratta di una raccolta formale e controllata di tutte le istruzioni, le specifiche e le procedure necessarie per realizzare un prodotto coerente. Il DMR contiene tutto, dai disegni di progettazione e dalle specifiche dei materiali alle istruzioni di produzione dettagliate, ai metodi di test per il controllo qualità, all'etichettatura e ai requisiti di imballaggio. Consideratelo come il progetto completo; definisce esattamente come il dispositivo deve essere realizzato, dall'inizio alla fine.
- Il registro cronologico del dispositivo, o DHR, È la prova che uno specifico lotto, lotto o singola unità è stato effettivamente costruito secondo quella ricetta. È il registro di produzione completo. Il DHR contiene le date specifiche di produzione, le quantità prodotte, i risultati dei test per quel lotto e informazioni di tracciabilità come numeri di serie o di lotto. Mentre il DMR è il manuale di istruzioni che si applica a tutte le unità, il DHR è la prova storica che dimostra che una specifica produzione ha seguito quelle istruzioni e ha soddisfatto tutti i criteri di accettazione.
4. Convalida il tuo lavoro e il tuo processo

La convalida è la prova documentata che un processo, un sistema o un'apparecchiatura producono costantemente il risultato atteso. Questo principio impone ai produttori di dimostrare che i loro processi sono affidabili...
You have read 14% of the article. The rest is for our community. Already a member? Accedi
(e anche per proteggere i nostri contenuti originali dai bot di scraping)
Comunità Innovazione.mondo
Accedi o registrati (100% free)
Visualizza il resto di questo articolo e tutti i contenuti e gli strumenti riservati ai soci.
Solo veri ingegneri, produttori, designer, professionisti del marketing.
Nessun bot, nessun hater, nessuno spammer.
Domande frequenti
In un audit pratico, in che modo le aspettative di un ispettore in merito alle "cGMP" differiscono dalle normative "GMP" scritte?
Un ispettore si aspetta di verificare non solo che seguiate le vostre procedure scritte (GMP), ma anche che le vostre procedure stesse riflettano le migliori pratiche e tecnologie del settore (cGMP). Vi chiederà perché utilizzate un metodo analitico vecchio di 20 anni, quando uno più accurato e affidabile è ormai standard, o perché vi affidate a controlli manuali, quando la verifica automatizzata in linea è ormai comune. Stanno verificando la vostra consapevolezza e l'adozione proattiva dei moderni standard di qualità.
Le cGMP implicano che dobbiamo investire costantemente nelle tecnologie più recenti oppure possiamo giustificare l'utilizzo di apparecchiature più vecchie e convalidate?
È assolutamente possibile giustificare l'utilizzo di apparecchiature obsolete, ma l'onere della prova spetta a voi. La giustificazione deve essere documentata e basata sul rischio. È necessario dimostrare, attraverso una validazione solida, una manutenzione rigorosa, un monitoraggio intensivo e dati di tendenza, che il vostro vecchio sistema fornisce un livello equivalente o superiore di garanzia della qualità e controllo di processo rispetto alle alternative moderne. Se il tuo processo, basato su apparecchiature obsolete, presenta un tasso di deviazione più elevato, non sarai in grado di difenderlo.
Oltre alle piste di controllo, quali sono le lacune "invisibili" più comuni nell'integrità dei dati su cui si concentrano le autorità di regolamentazione?
Le autorità di regolamentazione stanno esaminando attentamente i fogli di calcolo non controllati utilizzati per i calcoli GMP, l'uso di credenziali di accesso condivise su apparecchiature autonome (come bilance o pHmetri) e la possibilità di eseguire "prove" su apparecchiature analitiche che possono essere eliminate senza lasciare traccia. Un'altra priorità fondamentale è l'integrità dei metadati, ovvero i dati relativi ai dati, come timestamp e ID utente, che devono essere collegati in modo sicuro al record originale.
In che modo un Sistema di Qualità Farmaceutica (PQS) conforme all'ICH Q10 si differenzia da un semplice reparto QA efficiente?
A strong QA department enforces quality; a PQS manages it as a business-wide objective. The key difference is the formal integration of senior management and a focus on process performance and continuous improvement. A PQS ensures that quality metrics directly influence business decisions (like resource allocation and strategic planning) and that management is actively reviewing and driving the system’s effectiveness, as opposed to delegating all quality matters to QA.
Cosa significa realmente per un ingegnere un "approccio basato sul ciclo di vita" alla convalida dei processi (secondo ASTM E2500)?
It means validation is no longer a “three-and-done” batch exercise. It’s a continuous process. For an engineer, this means: Stage 1 (Process Design): using Quality by Design (QbD) to define a robust process and its control space. Stage 2 (Process Qualification): verifying the facility and equipment are fit for purpose and that the process consistently works within its defined space (PPQ). Stage 3 (Continued Process Verification): actively monitoring the process during routine production using controllo statistico di processo (SPC) to ensure it remains in a state of control for its entire commercial life.
Qual è la differenza pratica più significativa tra le GMP dell'UE (EudraLex) e le cGMP degli Stati Uniti?
La differenza più significativa riguarda il ruolo della Persona Qualificata (QP) nell'UE. Negli Stati Uniti, l'Unità Qualità ha l'autorità di rilasciare un lotto. Nell'UE, una QP specificamente nominata deve certificare personalmente che ogni lotto sia stato prodotto e testato in conformità a tutte le normative e all'autorizzazione all'immissione in commercio prima di poter essere rilasciato. Ciò comporta un'enorme responsabilità personale e legale per un singolo individuo.
Il nostro sistema CAPA è conforme, ma i problemi si ripresentano spesso. Quali sono le aspettative cGMP per l'"efficacia del CAPA"?
Le cGMP prevedono che venga formalmente verificata l'efficacia delle CAPA. Ciò richiede l'inserimento di una fase di "verifica dell'efficacia" nella procedura CAPA. Questa verifica, eseguita settimane o mesi dopo l'implementazione della CAPA, deve fornire dati oggettivi (ad esempio, analisi dell'andamento dei tassi di deviazione, nuovi risultati di audit) per dimostrare che la causa principale è stata eliminata e che il problema non si è ripresentato. Una CAPA chiusa senza questa verifica rappresenta un importante campanello d'allarme per i revisori.
Come si sono evolute le aspettative cGMP per la qualificazione dei fornitori, andando oltre la semplice verifica del fornitore?
Gli audit sono ancora necessari, ma le cGMP ora richiedono un approccio più basato sui dati e sul rischio. Ciò include la definizione di Accordi di Qualità formali che definiscano le responsabilità, il monitoraggio delle prestazioni del fornitore attraverso parametri (ad esempio, puntualità nelle consegne, tassi di deviazione, qualità del materiale in entrata) e l'esecuzione di test periodici sulle materie prime per verificare il Certificato di Analisi (CoA) del fornitore. È necessario dimostrare una supervisione continua, non una qualifica una tantum.
Con la revisione dell'Allegato 1, qual è il cambiamento più significativo in termini di cGMP nella produzione sterile?
Il cambiamento più significativo riguarda l'obbligo di una Strategia di Controllo della Contaminazione (CCS) formale e olistica. Non si tratta di una semplice raccolta di procedure operative standard (SOP), ma di un documento unico e completo che giustifichi la progettazione, i processi e i programmi di monitoraggio della struttura sulla base della gestione del rischio. Impone di dimostrare come tutte le singole misure di controllo (dall'abbigliamento all'HVAC alla progettazione dei processi) interagiscano tra loro per prevenire la contaminazione.
Perché la tecnologia analitica di processo (PAT) è considerata un pilastro delle moderne cGMP?
Poiché il PAT incarna il principio fondamentale delle cGMP di integrare la qualità, anziché testarla. Fornendo dati in tempo reale durante il processo, il PAT consente il controllo attivo dei Parametri Critici di Processo (CPP) per garantire il rispetto degli Attributi Critici di Qualità (CQA). Questo sposta la produzione da un approccio rigido basato su ricette a un modello flessibile e scientifico, in grado di adattarsi a piccole variabilità e garantire un risultato coerente.
Come dovrebbe essere trattato l'"errore umano" come causa principale in un ambiente cGMP?
In un sistema cGMP maturo, l'"errore umano" è raramente una causa principale accettabile. Di solito è il sintomo di un processo o di un sistema difettoso. Quando si verifica un errore, l'indagine deve essere approfondita: la procedura era confusa? La formazione era inadeguata? L'ambiente di lavoro era mal progettato (ingegneria dei fattori umani)? L'operatore era affaticato a causa di un eccessivo straordinario? Una solida CAPA affronterà il problema di sistema sottostante, non si limiterà a riqualificare il singolo individuo.
La Revisione Annuale del Prodotto (PQR) è spesso vista come un compito arduo. Qual è il suo scopo previsto dalle cGMP?
Il suo scopo è quello di essere uno strumento proattivo per il miglioramento continuo. Il PQR non dovrebbe essere solo un'analisi retrospettiva dei dati. È un'opportunità formale per analizzare i dati di un anno (trend, deviazioni, cambiamenti, risultati di stabilità) per valutare lo stato di salute e la coerenza di un processo. Il suo output più importante dovrebbe essere un elenco di CAPA e miglioramenti di processo consigliati per l'anno successivo.
Letture correlate
Link esterni su
Standard internazionali
- ISO 22716:2007 Buone pratiche di fabbricazione (GMP) - Linee guida sulle buone pratiche di fabbricazione
- FDA 21 CFR Parte 210 e 211: Buone pratiche di fabbricazione correnti nella produzione, lavorazione, confezionamento o conservazione dei farmaci
- ISO 13485:2016 Dispositivi medici - Sistemi di gestione della qualità - Requisiti per scopi normativi
(passa il mouse sul link per vedere la nostra descrizione del contenuto)
Glossario dei termini utilizzati
American Society for Testing and Materials (ASTM): un'organizzazione internazionale di standardizzazione che sviluppa e pubblica standard tecnici volontari consensuali per materiali, prodotti, sistemi e servizi, volti a migliorare la qualità e la sicurezza in vari settori.
Application Programming Interface (API): un insieme di regole e protocolli che consente a diverse applicazioni software di comunicare e interagire tra loro, consentendo l'integrazione di funzionalità e lo scambio di dati tra sistemi.
Certificate of Analysis (CoA): un documento rilasciato da un produttore o da un laboratorio di prova che conferma le specifiche, la qualità e la conformità di un prodotto agli standard normativi, specificando i risultati dei test e i metodi utilizzati per l'analisi.
Contamination Control Strategy (CCS): un approccio sistematico per prevenire, rilevare e mitigare la contaminazione in ambienti controllati, garantendo la qualità e la sicurezza del prodotto attraverso procedure definite, monitoraggio e pratiche di gestione del rischio.
Corrective Action and Preventative Action (CAPA): un approccio sistematico per identificare, indagare e affrontare le non conformità e i potenziali problemi per prevenirne il ripetersi e garantire la conformità agli standard normativi nei sistemi di gestione della qualità.
Critical Control Points (CCP): Fasi specifiche di un processo in cui è possibile applicare il controllo per prevenire, eliminare o ridurre i rischi per la sicurezza alimentare a livelli accettabili. L'identificazione di questi punti è essenziale per un'analisi efficace dei rischi e una gestione dei controlli critici nei sistemi di produzione alimentare.
current Good Manufacturing Practice (cGMP): un sistema che garantisce che i prodotti siano costantemente realizzati e controllati secondo standard di qualità, comprendente normative e linee guida per i processi di produzione, le strutture, le attrezzature e il personale per garantire sicurezza, qualità ed efficacia nei settori farmaceutico, alimentare e altri settori regolamentati.
Device History Record (DHR): una raccolta di registri che documenta la cronologia di produzione di un dispositivo medico, inclusi i dati di fabbricazione, controllo qualità e collaudo, garantendo la conformità ai requisiti normativi e facilitando la tracciabilità durante l'intero ciclo di vita del dispositivo.
Device Master Record (DMR): una raccolta di documenti e specifiche che forniscono le informazioni necessarie per produrre un dispositivo medico, tra cui specifiche di progettazione, processi di produzione, misure di garanzia della qualità e requisiti di etichettatura, garantendo la conformità agli standard normativi.
Failure Mode and Effects Analysis (FMEA): un metodo sistematico per valutare le potenziali modalità di guasto all'interno di un sistema, processo o prodotto, valutandone gli effetti sulle prestazioni e dando priorità ai rischi per migliorare l'affidabilità e la sicurezza attraverso azioni correttive.
Food and Drug Administration (FDA): un'agenzia federale del Dipartimento della Salute e dei Servizi Umani degli Stati Uniti responsabile della regolamentazione della sicurezza alimentare, dei prodotti farmaceutici, dei dispositivi medici, dei cosmetici e dei prodotti del tabacco per garantire la salute e la sicurezza pubblica attraverso la valutazione scientifica e l'applicazione degli standard di conformità.
Good Manufacturing Practice (GMP): Un sistema che garantisce che i prodotti siano realizzati e controllati costantemente secondo standard di qualità, riducendo al minimo i rischi associati alla produzione farmaceutica e alle industrie correlate. Comprende linee guida per i processi di produzione, le condizioni degli impianti, le qualifiche del personale e le pratiche di documentazione per garantire la sicurezza e l'efficacia dei prodotti.
Hazard Analysis and Critical Control Points (HACCP): un approccio sistematico alla sicurezza alimentare che identifica, valuta e controlla i pericoli nei punti critici del processo produttivo per prevenire le malattie di origine alimentare e garantire la sicurezza del prodotto.
Heating Ventilation and Air Conditioning (HVAC): Un sistema progettato per regolare il clima interno controllando temperatura, umidità e qualità dell'aria attraverso processi di riscaldamento, raffreddamento e ventilazione. Include componenti come caldaie, condizionatori, canalizzazioni e termostati per una gestione ambientale efficiente.
Installation Qualification (IQ): un processo documentato per verificare che le apparecchiature o i sistemi siano installati secondo le specifiche, inclusa la valutazione delle utenze, delle condizioni ambientali e della conformità ai requisiti di progettazione, garantendo la prontezza per la qualificazione operativa.
International Organization for Standardization (ISO): Un organismo internazionale non governativo che sviluppa e pubblica standard per garantire qualità, sicurezza, efficienza e interoperabilità in vari settori industriali e commerciali, facilitando il commercio e la cooperazione globali. Fondato nel 1947, comprende organizzazioni nazionali di normazione dei paesi membri.
Key Performance Indicator (KPI): un valore misurabile che dimostra l'efficacia con cui un'organizzazione sta raggiungendo gli obiettivi aziendali chiave, spesso utilizzato per valutare il successo nel raggiungimento degli obiettivi.
Magnetic Resonance Imaging (MRI): una tecnica di imaging medico che utilizza forti campi magnetici e onde radio per generare immagini dettagliate delle strutture interne del corpo, in particolare dei tessuti molli, rilevando i segnali emessi dai nuclei di idrogeno in presenza di un campo magnetico.
Operational Qualification (OQ): un processo di convalida che garantisce che le apparecchiature o i sistemi funzionino secondo requisiti specifici entro limiti definiti, confermando che funzionano come previsto nel loro ambiente operativo.
parts per million (ppm): Unità di misura che rappresenta la concentrazione di una sostanza in un milione di parti di un'altra, spesso utilizzata per quantificare inquinanti o contaminanti nell'aria, nell'acqua o nel suolo. Equivale a milligrammi di sostanza per litro di soluzione o per chilogrammo di materiale.
Performance Qualification (PQ): un processo che verifica che un sistema o un'apparecchiatura funzioni secondo requisiti specifici in condizioni reali, assicurando che svolga costantemente la funzione prevista entro limiti predeterminati.
Product Lifecycle Management (PLM): un approccio sistematico alla gestione del ciclo di vita di un prodotto, dall'ideazione alla progettazione ingegneristica e alla produzione, fino all'assistenza e allo smaltimento, integrando persone, processi, dati e tecnologia per migliorare la qualità del prodotto, ridurre i tempi di commercializzazione e migliorare la collaborazione tra le parti interessate.
Qualified Person (QP): una persona dotata dell'istruzione, dell'esperienza e dell'autorità necessarie per supervisionare e garantire la conformità ai requisiti normativi nella preparazione e presentazione di documenti tecnici, in particolare nei settori minerario e delle risorse, come definito dagli standard industriali pertinenti.
Standard Operating Procedure (SOP): una serie di istruzioni dettagliate create per aiutare i lavoratori a svolgere le operazioni di routine in modo coerente ed efficiente, garantendo il rispetto delle normative e degli standard di qualità.
Statistical Process Control (SPC): un metodo di controllo qualità che impiega tecniche statistiche per monitorare e controllare un processo, assicurandone il funzionamento al massimo delle sue potenzialità mediante l'identificazione delle variazioni e il mantenimento di un output coerente entro limiti specificati.