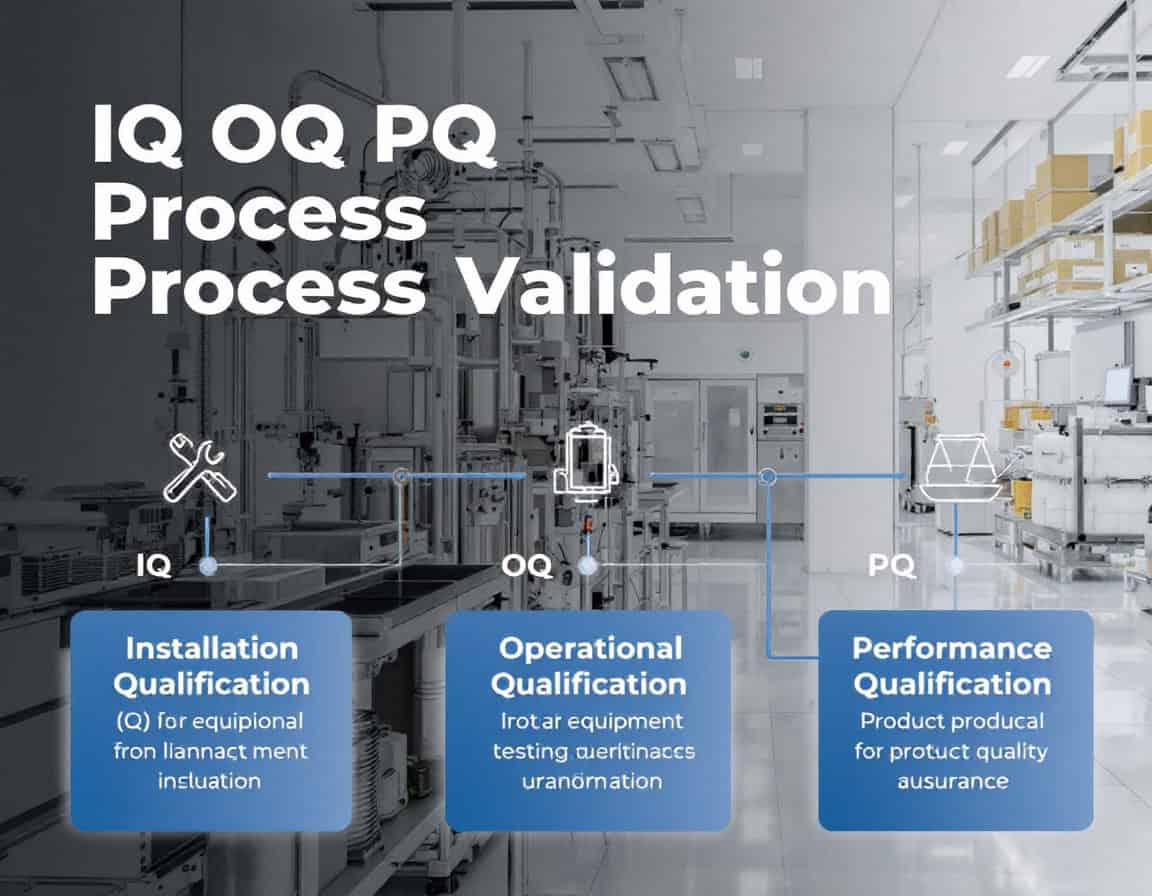
La metodologia di convalida del processo IQ OQ PQ, che sta per sequenza Installation Qualification (IQ), Operational Qualification (OQ) e Performance Qualification (PQ), costituisce la procedura consolidata struttura per la convalida di processo, che consiste nella generazione sistematica di prove documentate che un processo produttivo sia in stato di controllo. Questa metodologia segue una progressione deliberata e logica, iniziando con la verifica statica e documentata della corretta installazione dell'apparecchiatura (IQ), passando alla conferma dinamica del funzionamento affidabile dell'apparecchiatura nei limiti specificati (OQ) e culminando nella dimostrazione che il processo integrato produce costantemente un prodotto che soddisfa tutti gli attributi di qualità (PQ).
L'intera sequenza è progettata per fornire una prova oggettiva e tracciabile che il processo sia solido, riproducibile e idoneo allo scopo previsto prima dell'uso commerciale.
Questa metodologia è un prerequisito normativo non negoziabile nei settori regolati da cGMP, come i prodotti farmaceutici, biologici e dispositivo medico produzione, dove la coerenza del processo è direttamente correlata alla sicurezza del paziente. La sua applicazione non è rivolta alla ricerca iniziale, ma alla fase critica di convalida condotta dopo il completamento dello sviluppo del processo e prima che il processo venga approvato per la produzione commerciale di routine.
Punti Chiave

- L'output della convalida è una prova, non un prodotto.
- I test OQ nel “caso peggiore” comportano fattori di stress combinati.
- PQ convalida il processo integrato, non solo l'attrezzatura.
- La regola dei “tre lotti” dimostra la riproducibilità.
- Il successo del PQ è determinato dalla costanza, non dal semplice superamento delle specifiche.
- Il protocollo è un contratto; le deviazioni devono essere giustificate e ben documentate.
- Sfrutta la documentazione del fornitore (FAT/SAT), ma non sostituire il tuo OQ
- La convalida definisce l'inizio del ciclo di vita, non la fine di un progetto.
- Ogni modifica “simile” richiede una giustificazione.
- La formazione del personale è un prerequisito per OQ e PQ
Qualifica di installazione (IQ)
La Qualificazione dell'Installazione (IQ) è la fase iniziale e fondamentale della metodologia di convalida del processo IQ OQ PQ. Si tratta di un processo formale e documentato che verifica e conferma che apparecchiature, sistemi e componenti ausiliari siano stati consegnati, installati e configurati in completa conformità con le raccomandazioni del produttore e le specifiche di progettazione dell'utente.
Il principio fondamentale dell'IQ è fornire prove documentate che l'installazione sia corretta e crei un ambiente adatto e sicuro per le successive fasi di qualificazione.
Lo scopo e l'importanza del QI: L'obiettivo principale dell'IQ è stabilire una base di riferimento per la convalida dell'apparecchiatura. Prima di iniziare qualsiasi test operativo, è fondamentale assicurarsi che l'apparecchiatura sia fisicamente presente, correttamente assemblata e situata in un ambiente appropriato. Questa fase riduce i rischi associati a un'installazione non corretta, che potrebbe altrimenti causare malfunzionamenti dell'apparecchiatura, problemi di qualità del prodotto e rischi per la sicurezza.
Fasi e attività chiave nella qualificazione dell'installazione
Il processo di QI è sistematico e prevede diverse fasi dettagliate, solitamente gestite tramite un protocollo e una checklist pre-approvati.
1. Pre-installazione e pianificazione
Prima ancora che l'attrezzatura arrivi o venga ordinata, il processo IQ inizia con un'attenta pianificazione. Questo include:
- Verifica dell'idoneità del sito: assicurarsi che il luogo designato sia predisposto per la nuova apparecchiatura. Ciò implica la verifica di uno spazio adeguato, del supporto strutturale e della disponibilità dei servizi necessari nei punti di allacciamento corretti.
- Condizioni ambientali: verificando che l'ambiente di installazione soddisfi le specifiche del produttore in termini di temperatura, umidità e pulizia.
- Raccolta della documentazione: raccogliere tutti i documenti essenziali, come l'ordine di acquisto, i manuali del produttore, le specifiche di progettazione, i disegni tecnici e i certificati di calibrazione per tutti gli strumenti di misura integrati.
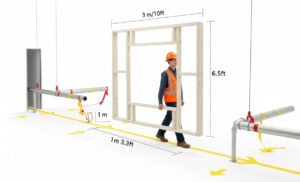
Mancia: Percorri il percorso e modella il volume. Non limitarti a guardare una planimetria 2D. I guasti IQ più comuni e costosi si verificano qui. Percorri letteralmente il percorso pianificato dalla banchina di carico al punto di installazione finale con i tuoi principali stakeholder (impianti, ingegneria e il project manager del fornitore). Utilizza un semplice telaio in legno o PVC costruito secondo le dimensioni massime di altezza, larghezza e lunghezza della macchina. Trasporta fisicamente questo telaio "fantasma" lungo l'intero percorso. Questo rivelerà problemi di spazio con porte, tubi bassi, angoli stretti e capacità degli ascensori che spesso non vengono rilevati nei disegni. Verificare inoltre la capacità di carico del pavimento non solo nel punto finale, ma lungo l'intero percorso di transito.

2. Ricezione e verifica dell'attrezzatura
Una volta consegnata l'attrezzatura, viene effettuata un'ispezione approfondita:
- Verifica dei componenti: gli articoli consegnati vengono controllati meticolosamente rispetto alla lista di imballaggio e all'ordine di acquisto per confermare che tutti i componenti, incluso il software, siano stati ricevuti e siano del modello e della versione corretti ordinati.
- Ispezione per danni: viene effettuata un'ispezione visiva per garantire che non si siano verificati danni durante la spedizione e la movimentazione.
Nota: Nella maggior parte dei settori che adottano la metodologia IQ OQ PQ, le apparecchiature devono essere corredate dai relativi certificati di conformità (marcature CE, FDA, ecc.), eventualmente da altri certificati e, possibilmente, dai risultati di alcuni test interni al produttore. Questi documenti devono essere considerati allo stesso modo e con la stessa importanza dei beni materiali stessi. Infatti, una consegna dovrebbe essere rifiutata se questi documenti non sono inclusi o ricevuti in anticipo (almeno in zona di quarantena).
Suggerimento correlato: Fidatevi, ma verificate il firmware. La lista di imballaggio è il minimo indispensabile. La vostra vera attenzione dovrebbe essere rivolta ai componenti critici e, soprattutto, alle versioni di software e firmware. Un fornitore potrebbe spedire una versione più recente e "migliore" che non è stata convalidata per il vostro processo. Prima che l'autista parta e prima di firmare qualsiasi documento di spedizione, scattate foto ad alta risoluzione delle targhette di tutti i componenti critici (motori, pompe, controller) e della targhetta dell'apparecchiatura principale. Se possibile, accendete l'unità di controllo solo per verificare la versione del firmware/software sulla schermata di avvio. Confrontatela con la versione specificata nelle vostre Specifiche dei Requisiti Utente (URS) o nell'ordine di acquisto. Rifiutare la spedizione alla porta è molto più semplice che gestire la discrepanza in un secondo momento.
3. Installazione e verifica della connessione
Questo è il fulcro del processo IQ, in cui l'installazione fisica viene esaminata attentamente:

- Montaggio e posizionamento corretti: verificare che l'attrezzatura sia assemblata e posizionata secondo le istruzioni del produttore e i disegni tecnici.
- Collegamenti di utilità: Si tratta di un passaggio fondamentale che prevede la conferma di tutte le connessioni ai servizi essenziali. Ciò include la verifica che:
- Elettrico: che l'alimentatore corrisponda alla tensione e alla fase richieste e che siano presenti circuiti di messa a terra e di sicurezza adeguati.
- Idraulica: i collegamenti per l'acqua, il vapore o lo scarico siano installati correttamente, privi di perdite e realizzati con materiali appropriati.
- Gas e aria compressa: tutte le linee pneumatiche e del gas sono collegate correttamente e la pressione e la qualità sono conformi alle specifiche.
- Attrezzatura ausiliaria: assicurandosi che anche tutte le apparecchiature di supporto o periferiche siano installate e collegate correttamente.
- Installazione del software:for computer-controlled systems, this involves verifying that the software is installed correctly, communication with the...
You have read 14% of the article. The rest is for our community. Already a member? Accedi
(e anche per proteggere i nostri contenuti originali dai bot di scraping)
Comunità Innovazione.mondo
Accedi o registrati (100% free)
Visualizza il resto di questo articolo e tutti i contenuti e gli strumenti riservati ai soci.
Solo veri ingegneri, produttori, designer, professionisti del marketing.
Nessun bot, nessun hater, nessuno spammer.
Letture correlate
- Piano generale di convalida (VMP): il documento strategico di alto livello che definisce la filosofia di convalida complessiva dell'azienda, la portata, le responsabilità e i sistemi e i processi specifici da convalidare.
- Specifiche dei requisiti utente (URS): il documento fondamentale che descrive in dettaglio cosa ci si aspetta che l'attrezzatura o il processo facciano dal punto di vista dell'utente finale e della qualità, costituendo la base per tutti i test successivi.
- Test di accettazione in fabbrica (FAT) e test di accettazione in loco (SAT): test preliminari guidati dall'ingegneria, spesso eseguiti con il fornitore, per verificare la funzionalità dell'apparecchiatura prima della spedizione (FAT) e dopo l'installazione (SAT), che possono essere sfruttati per semplificare IQ/OQ.
- Validazione del sistema informatico (CSV): una disciplina di convalida specializzata che funziona parallelamente a IQ OQ PQ, concentrandosi sull'integrità, la sicurezza e l'affidabilità del software e dei sistemi computerizzati che controllano le apparecchiature.
- Conformità alla Parte 11 del 21 CFR: l'insieme specifico di normative FDA che regolano i record elettronici e le firme elettroniche, una componente fondamentale del CSV per garantire l'integrità dei dati, le piste di controllo e il controllo degli accessi.
- Convalida della pulizia: un processo di convalida a volte separato ma correlato eseguito sulla stessa apparecchiatura per dimostrare che una procedura di pulizia può rimuovere in modo efficace e coerente i residui di prodotto, gli agenti pulenti e la contaminazione microbica (si consiglia vivamente di includerlo nel protocollo IQ OQ PQ, poiché lo stato di pulizia è parte integrante delle prestazioni del prodotto e del processo).
- Analisi del sistema di misura (MSA) / R&R del calibro: la metodologia statistica utilizzata per convalidare i *metodi di prova* stessi, garantendo che il sistema di misurazione utilizzato per giudicare la qualità del prodotto sia accurato, preciso, ripetibile e riproducibile.
- Validazione basata sul rischio (utilizzando FMEA/HACCP): la metodologia per identificare potenziali modalità di guasto e rischi per la qualità del prodotto, consentendo di concentrare gli sforzi di convalida sui parametri di processo più critici (CPP).
- Attributi critici di qualità (CQA) e parametri critici di processo (CPP): le caratteristiche specifiche e definite del prodotto (CQA) e le variabili di processo (CPP) che devono essere controllate per garantire la qualità desiderata del prodotto, che costituiscono i criteri di accettazione per la PQ.
- Capacità di processo Analysis (Cpk/Ppk): l'analisi statistica eseguita sui dati PQ per quantificare quanto un processo sia centrato entro i suoi limiti di specifica e quanta variabilità abbia, fornendo un punteggio numerico della sua "capacità".
- Verifica del processo continuo (CPV): la moderna “Fase 3” di convalida del processo, che prevede il monitoraggio continuo dei parametri di processo e degli attributi di qualità durante la produzione di routine per garantire che il processo rimanga in un costante stato di controllo.
- Gestione del controllo delle modifiche: la procedura formale del sistema di qualità per valutare, documentare e approvare qualsiasi modifica proposta a un sistema o processo convalidato per garantire che non esca involontariamente dal suo stato convalidato.
- Gestione delle deviazioni e CAPA: il sistema per indagare, determinare la causa principale e implementare azioni correttive e preventive per qualsiasi imprevisto eventi o errori che si verificano durante o dopo la convalida.
- Validazione retrospettiva: un approccio di convalida obsoleto, ormai raramente accettabile, basato sull'analisi dei dati di produzione storici di un processo esistente e non convalidato per tentare di dimostrare che ha funzionato in uno stato di controllo.
- Rapporto di sintesi della convalida (VSR): il documento finale e conclusivo che riassume l'intero sforzo di convalida (IQ OQ PQ), presenta i risultati chiave, affronta eventuali deviazioni e dichiara formalmente il sistema o il processo come convalidato e idoneo all'uso commerciale.
Link esterni sulla convalida del processo IQ OQ PQ
Standard internazionali
(passa il mouse sul link per vedere la nostra descrizione del contenuto)
Glossario dei termini utilizzati
American Society for Testing and Materials (ASTM): un'organizzazione internazionale di standardizzazione che sviluppa e pubblica standard tecnici volontari consensuali per materiali, prodotti, sistemi e servizi, volti a migliorare la qualità e la sicurezza in vari settori.
Calculation of Process Capability (Cpk): una misura statistica che valuta la capacità di un processo di produrre output entro limiti specificati, calcolata valutando la distanza tra la media del processo e il limite di specifica più vicino, normalizzata dalla deviazione standard del processo.
Computer Numerically Controlled (CNC): un processo di produzione che utilizza software programmati per controllare le macchine utensili, consentendo un funzionamento preciso e automatizzato per attività quali il taglio, la fresatura, la foratura e l'incisione di materiali.
Continuous Integration/Continuous Deployment (CI/CD): una pratica di sviluppo software che automatizza l'integrazione delle modifiche al codice e la distribuzione negli ambienti di produzione, consentendo aggiornamenti frequenti, consegne più rapide e una migliore collaborazione tra i team di sviluppo e operativi attraverso test e monitoraggio automatizzati.
Corrective Action and Preventative Action (CAPA): un approccio sistematico per identificare, indagare e affrontare le non conformità e i potenziali problemi per prevenirne il ripetersi e garantire la conformità agli standard normativi nei sistemi di gestione della qualità.
Critical Control Points (CCP): Fasi specifiche di un processo in cui è possibile applicare il controllo per prevenire, eliminare o ridurre i rischi per la sicurezza alimentare a livelli accettabili. L'identificazione di questi punti è essenziale per un'analisi efficace dei rischi e una gestione dei controlli critici nei sistemi di produzione alimentare.
current Good Manufacturing Practice (cGMP): un sistema che garantisce che i prodotti siano costantemente realizzati e controllati secondo standard di qualità, comprendente normative e linee guida per i processi di produzione, le strutture, le attrezzature e il personale per garantire sicurezza, qualità ed efficacia nei settori farmaceutico, alimentare e altri settori regolamentati.
Defects Per Million Opportunities (DPMO): una misura utilizzata nel controllo qualità che quantifica il numero di difetti in un processo per un milione di opportunità di errore, calcolato dividendo il numero di difetti per il numero totale di opportunità e moltiplicando per un milione.
Define Measure Analyze Improve Control (DMAIC): una strategia di qualità basata sui dati utilizzata in Six Sigma per il miglioramento dei processi, composta da cinque fasi: identificazione del problema, misurazione delle prestazioni attuali, analisi dei dati per identificare le cause, miglioramento dei processi in base ai risultati e controllo delle prestazioni future per sostenere i miglioramenti.
Design Validation (DV): un processo volto a garantire che un prodotto soddisfi i requisiti specificati e l'uso previsto attraverso test e valutazioni, confermando che il progetto soddisfa il suo scopo e funziona correttamente in condizioni reali.
Failure Mode and Effects Analysis (FMEA): un metodo sistematico per valutare le potenziali modalità di guasto all'interno di un sistema, processo o prodotto, valutandone gli effetti sulle prestazioni e dando priorità ai rischi per migliorare l'affidabilità e la sicurezza attraverso azioni correttive.
Food and Drug Administration (FDA): un'agenzia federale del Dipartimento della Salute e dei Servizi Umani degli Stati Uniti responsabile della regolamentazione della sicurezza alimentare, dei prodotti farmaceutici, dei dispositivi medici, dei cosmetici e dei prodotti del tabacco per garantire la salute e la sicurezza pubblica attraverso la valutazione scientifica e l'applicazione degli standard di conformità.
Good Manufacturing Practice (GMP): Un sistema che garantisce che i prodotti siano realizzati e controllati costantemente secondo standard di qualità, riducendo al minimo i rischi associati alla produzione farmaceutica e alle industrie correlate. Comprende linee guida per i processi di produzione, le condizioni degli impianti, le qualifiche del personale e le pratiche di documentazione per garantire la sicurezza e l'efficacia dei prodotti.
Hazard Analysis and Critical Control Points (HACCP): un approccio sistematico alla sicurezza alimentare che identifica, valuta e controlla i pericoli nei punti critici del processo produttivo per prevenire le malattie di origine alimentare e garantire la sicurezza del prodotto.
Installation Qualification (IQ): un processo documentato per verificare che le apparecchiature o i sistemi siano installati secondo le specifiche, inclusa la valutazione delle utenze, delle condizioni ambientali e della conformità ai requisiti di progettazione, garantendo la prontezza per la qualificazione operativa.
Measurement System Analysis (MSA): un metodo statistico utilizzato per valutare l'accuratezza, la precisione e l'affidabilità dei processi e degli strumenti di misurazione, garantendo che i dati raccolti siano validi e coerenti per il processo decisionale nel controllo qualità e nel miglioramento dei processi.
Operational Qualification (OQ): un processo di convalida che garantisce che le apparecchiature o i sistemi funzionino secondo requisiti specifici entro limiti definiti, confermando che funzionano come previsto nel loro ambiente operativo.
Performance Qualification (PQ): un processo che verifica che un sistema o un'apparecchiatura funzioni secondo requisiti specifici in condizioni reali, assicurando che svolga costantemente la funzione prevista entro limiti predeterminati.
Process Capability Index (Cpk): una misura statistica che quantifica la capacità di un processo di produrre output entro limiti specificati, indicando la relazione tra la media del processo e il limite di specifica più vicino, aggiustato per la variabilità del processo.
Process Performance Index (Ppk): Misura statistica che quantifica il grado di conformità di un processo ai limiti di specifica, calcolata utilizzando la media e la deviazione standard del processo. Indica la capacità di un processo di produrre output entro limiti definiti, tenendo conto sia della variabilità che della centratura.
Product Lifecycle Management (PLM): un approccio sistematico alla gestione del ciclo di vita di un prodotto, dall'ideazione alla progettazione ingegneristica e alla produzione, fino all'assistenza e allo smaltimento, integrando persone, processi, dati e tecnologia per migliorare la qualità del prodotto, ridurre i tempi di commercializzazione e migliorare la collaborazione tra le parti interessate.
Production Part Approval Process (PPAP): una procedura standardizzata utilizzata nella produzione per garantire che i fornitori soddisfino i requisiti di qualità prima della produzione di massa, che prevede la documentazione e la convalida delle specifiche di progettazione, delle capacità di processo e dei campioni di produzione per confermare la conformità alle aspettative del cliente.
Quality Management System (QMS): un sistema strutturato di processi, procedure e responsabilità volti a garantire una qualità costante nei prodotti e nei servizi, a facilitare il miglioramento continuo e a soddisfare i requisiti normativi e dei clienti.
Standard Operating Procedure (SOP): una serie di istruzioni dettagliate create per aiutare i lavoratori a svolgere le operazioni di routine in modo coerente ed efficiente, garantendo il rispetto delle normative e degli standard di qualità.
Statistical Process Control (SPC): un metodo di controllo qualità che impiega tecniche statistiche per monitorare e controllare un processo, assicurandone il funzionamento al massimo delle sue potenzialità mediante l'identificazione delle variazioni e il mantenimento di un output coerente entro limiti specificati.
User Requirement Specification (URS): un documento che descrive in dettaglio le esigenze e le aspettative degli utenti per un sistema o un prodotto, delineando i requisiti funzionali e non funzionali per guidare lo sviluppo e garantire l'allineamento con gli obiettivi dell'utente.
























Post correlati
Ultime pubblicazioni e brevetti sui framework organici covalenti (COF)
Ultime pubblicazioni e brevetti su aerogel e aerografene
Ultime pubblicazioni e brevetti sugli ossidi ad alta entropia (HEO)
Ultime pubblicazioni e brevetti sugli MXeni
Ultime pubblicazioni e brevetti sui Quantum Dots
Ultime pubblicazioni e brevetti sulle perovskiti