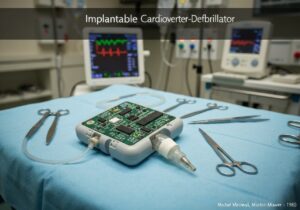
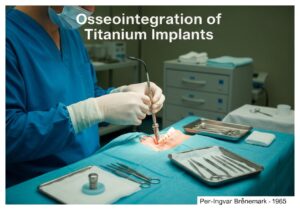
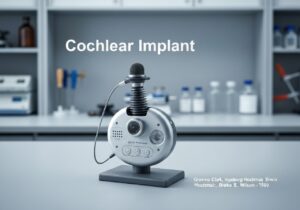
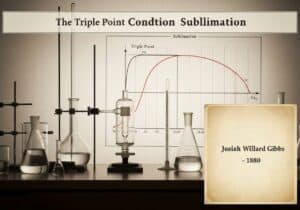
I dispositivi medici sono classificati in classi in base al rischio che rappresentano per pazienti e utilizzatori. Questo approccio basato sul rischio, utilizzato da enti regolatori come la FDA statunitense e nell'UE, prevede in genere tre o quattro livelli (ad esempio, Classe I, IIa, IIb, III). I dispositivi a basso rischio, come gli abbassalingua, rientrano nella Classe I, mentre i dispositivi ad alto rischio, come i pacemaker, rientrano nella Classe III.