Processus systématique d'identification, de documentation et de traitement des non-conformités existantes (action corrective) et des non-conformités potentielles futures (action préventive) afin d'améliorer la qualité et la conformité.
- Méthodologies : Ingénierie, Qualité
CAPA (Action corrective et préventive)

CAPA (Action corrective et préventive)
- Amélioration continue, Mesure corrective, Amélioration des processus, Assurance qualité, Contrôle de qualité, Gestion de la qualité, Gestion des risques, Analyse des causes profondes, Vérification
Objectif :
Comment il est utilisé :
- Il s'agit de rechercher la cause profonde d'un problème identifié, de mettre en œuvre des actions pour le corriger et d'éviter qu'il ne se reproduise. Dans le cadre d'une action préventive, les problèmes potentiels sont identifiés et des mesures sont prises pour éviter qu'ils ne se produisent. Comprend la vérification de l'efficacité.
Avantages
- Permet d'améliorer durablement la qualité en s'attaquant aux causes profondes ; contribue à satisfaire aux exigences réglementaires (ISO, FDA, etc.) ; empêche la réapparition des problèmes et l'apparition de problèmes potentiels ; améliore la satisfaction des clients.
Inconvénients
- Peut être bureaucratique et prendre du temps si elle n'est pas gérée efficacement ; nécessite une analyse approfondie des causes profondes, qui peut être complexe ; l'efficacité dépend d'une mise en œuvre et d'un suivi adéquats ; peut nécessiter des ressources importantes pour l'enquête et l'action.
Catégories :
- Lean Sigma, Fabrication, Qualité, Gestion des risques
Idéal pour :
- Traiter et prévenir les non-conformités des produits et des processus, respecter les normes réglementaires et favoriser l'amélioration continue.
The CAPA methodology is frequently utilized across diverse sectors such as pharmaceuticals, biotechnology, medical devices, automotive, and manufacturing, contributing to enhancing product quality, safety, and compliance with industry standards. Techniques used within CAPA often involve Quality Management Systems (QMS) and Six Sigma methodologies to analyze failures systematically, ensuring that corrective actions are not only thorough but also actionable and measurable. Typically, this methodology is initiated by quality assurance teams or engineers who have identified a defect, non-conformance, or potential risk during product testing or customer feedback analysis, necessitating cross-functional collaboration with R&D, manufacturing, and supply chain stakeholders. Common applications include addressing product recalls, analyzing customer complaints, or building risk mitigation plans for foreseeable issues, reinforcing a culture of quality assurance that aligns with regulatory expectations like those imposed by the FDA or ISO standards. Evaluating the effectiveness of implemented actions is an ongoing process, often involving follow-up audits or metrics assessments, thereby fostering a proactive stance towards quality management that can lead to enhanced customer satisfaction and loyalty while enabling organizations to sustain continuous improvements in their operational processes and product offerings. Engaging employees at all levels in CAPA initiatives promotes accountability and encourages a shared commitment to excellence within the organization, ultimately leading to a more resilient product development cycle de vie that minimizes waste and optimizes resource allocation.
Principales étapes de cette méthodologie
- Identify and document the problem or non-conformance.
- Conduct a root cause analysis to determine the underlying reasons.
- Develop corrective action plans to address the identified root causes.
- Implement corrective actions and monitor for effectiveness.
- Evaluate the effectiveness of corrective actions and assess impacts.
- Identify potential issues and develop preventive action plans.
- Implement preventive actions and verify their effectiveness.
- Monitor results and review processes for continuous improvement.
Conseils de pro
- Utilize advanced root cause analysis techniques such as Fishbone diagrams or the 5 pourquoi to identify underlying issues comprehensively.
- Integrate CAPA processes with other quality management systems to ensure cross-functional collaboration and real-time feedback loops.
- Employ data analytics to predict potential non-conformances, allowing for proactive measures and increasing efficiency in preventive actions.
Lire et comparer plusieurs méthodologies, nous recommandons le
> Référentiel méthodologique étendu <
ainsi que plus de 400 autres méthodologies.
Vos commentaires sur cette méthodologie ou des informations supplémentaires sont les bienvenus sur le site web de la Commission européenne. section des commentaires ci-dessous ↓ , ainsi que toute idée ou lien en rapport avec l'ingénierie.
Contexte historique
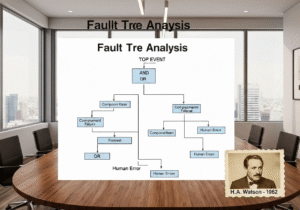
1962
1970
1972
1980
1980
1986
1986
1960
1963
1970
1980
1980
1980
1986
1987
(si la date est inconnue ou n'est pas pertinente, par exemple "mécanique des fluides", une estimation arrondie de son émergence notable est fournie)













Articles Similaires
Gestion des opérations de fabrication (MOM)
Système d'exécution de la fabrication (MES)
Plan de contrôle de la fabrication
Tests manuels
Tableaux d'évaluation des manutentions manuelles (MAC)
ManTRA (outil d'évaluation des risques liés aux tâches manuelles)