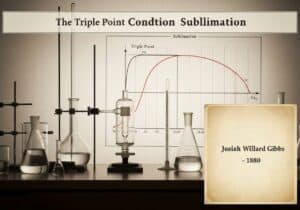
La température critique est la température au-dessus de laquelle une phase liquide distincte ne peut se former, quelle que soit la pression appliquée. Chaque gaz possède une température critique unique. Pour liquéfier un gaz, il faut d'abord le refroidir en dessous de cette température. Ce concept, établi par Thomas Andrews, est fondamental pour comprendre les conditions requises pour tout processus de liquéfaction.